GS1 HEALTHCARE SUMMIT 2020 – регулаторни изисквания за медицинските изделия
Вторият ден от глобалното събитие на GS1 беше посветен на регулаторните изисквания относно идентификацията и проследимостта на медицинските изделия в различни страни по света. Направен бе „обход“ и проследяване на сроковете и очаквани бъдещи предизвикателства при прилагането на UDI – Unique Device Identification на голяма част от света.
Като се започне от САЩ през 2013 година, когато Форумът на регулаторните органи от цял свят (IMDRF) взема решение за въвеждането на единна идентификация на медицинските изделия- UDI. Регулациите в тази връзка предвиждат изграждането на единна база данни с информация за медицинските изделия и UDI на всяко медицинско изделие. Така всяка държава започва изграждането на собствена регулаторна рамка и единна база данни на държавно ниво. В САЩ изградената и вече работеща база данни е GUDID.
В отговор на непрекъснато нарастващите изисквания за сигурни, валидирани данни за продуктите, Европейския съюз (ЕС) залага създаването на регулаторна рамка за здравната индустрия, представена в последната Regulation EU 2020/561, приета на 23 април, и изменяйки MDR (Medicine Device Regulation) по отношение на датите за прилагането. За различните класове медицински и имплантируеми изделия – до 2027г. Разбира се е изградена и европейска база данни EUDAMED, в която всички производители са задължени да въвеждат основни данни за изделията си с цел проследимост.
Саудитската асоциация по храните и лекарствата (SFDA) вече е издала „Ръководство за изискванията за уникална идентификация (UDI) на медицинските изделия“ (MDS-G34) през април 2019 г. и актуализация през септември 2020 г. Целите на SFDA UDI са да повиши безопасността на пациентите чрез подобряване на проследимостта на изделията, документация и свързаните с тях данни за докладване на нежелани събития, изтегляния и следене на пазара. Очаква се UDI да се използва за по-добър контрол на входните пристанища, за пациента и в системите за закупуване и управление на запасите.
Страни като Китай, Южна Корея, Канада също създават своите регулации и бази данни, макар че пътят е труден и дълъг предвид мащабите на страните, както и данните, които трябва да бъдат обхванати. В Австралия през септември 2020 година правителството отпуска 7 милиона долара, за да бъде изградена в рамките на 4 години действаща UDI система.
Общото между регулациите по света е използването на GS1 като световен стандарт за идентификация на медицинските изделия и глобалната мрежа за синхронизация на данни (GDSN) за вливане на основните данни за изделията в UDI бази данни. Използването на основния идентификатор GTIN /глобален номер на търговска единица/ като UDI- DI позволява на производителите на изделия да свържат записите на своите UDI с GDSN. Мрежата се използва от търговски партньори в цялата здравна индустрия (включително производители, дистрибутори и болнични мрежи) за обмен на данни за продукти в стандартен формат. Чрез споделяне на UDI данни с GDSN-сертифициран пул, данните за изделията се прехвърлят и в UDI базите данни на съответните държави. Към момента такава връзка е създадена с американската база данни GUDID, но върху такава връзка се работи и за европейската база данни EUDAMED, както и за няколко азиатски държави.
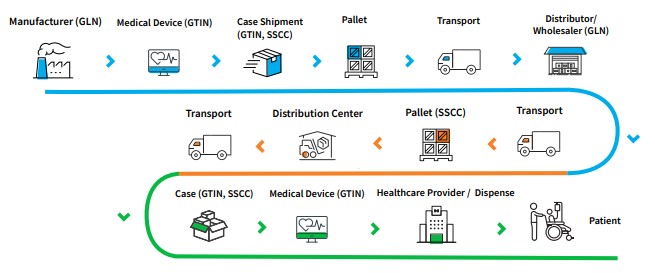
Кратка схема, на идентификацията и приложението по веригата на доставки:
За повече информация от събитието, моля да се обръщате към Д. Димитрова, експерт в GS1 България, на тел. +359 888923487и desislava.dimitrova@gs1bg.org




